糖尿病足溃疡是一种严重的糖尿病并发症,不仅严重影响患者的生活质量,还带来重大的临床和经济负担。糖尿病足溃疡易于在高血糖和缺氧环境下被细菌感染,并因免疫细胞功能受损而难以控制病原体。这导致糖尿病足感染,是导致下肢截肢的主要原因。此外,高细菌负荷和活性氧水平的升高会引发持续的炎症反应,扰乱免疫平衡,妨碍伤口愈合过程。目前的治疗策略如生物工程皮肤、生长因子、抗氧化和抗菌疗法往往侧重单一疗法,效果有限。因此,开发一种综合治疗策略,既能消灭细菌又能重塑氧化还原与免疫稳态,对于糖尿病足感染的治疗至关重要。
在此,伟德国际bv1946张春秋研究员、张松教授共同报告了一种 Janus 脂质酶的开发情况,这种酶既能治疗感染,又能促进伤口闭合和再上皮化。Janus 脂质酶由脂质体类硒酶组成,可清除活性氧,恢复组织氧化还原和免疫平衡。这种脂质酶可封装光敏剂,用于感染的光动力疗法。作者展示了在耐甲氧西林金黄色葡萄球菌感染的糖尿病伤口中的应用,结果显示光敏剂具有高水平的 ROS 抗菌功能,而脂质酶则能清除纳米 ROS,从而恢复组织的氧化还原和免疫平衡。作者证明,脂质酶可以直接调节巨噬细胞的极化,并诱导一种促进再生的反应。通过采用单细胞 RNA 测序、T 细胞缺陷 Rag1-/- 小鼠和皮肤浸润免疫细胞分析,作者进一步揭示了产生 IL-17 的 γδ T 细胞是介导 M1/M2 巨噬细胞转化的关键。使用脂质酶操纵局部免疫平衡对小鼠和迷你猪的皮肤伤口修复和组织再生很有效。相关成果以“Janus liposozyme for the modulation of redox and immune homeostasis in infected diabetic wounds”为题发表在《Nature Nanotechnology》,第一作者为魏婷婷,Tiezheng Pan, Xiuping Peng, Mengjuan Zhang.为共同一作。

脂质酶的合成、制备及表征
TSeL 的形态、大小和 zeta 电位与 SeL 相似(图 1b、c)。为了验证 TSeL 的 Janus 特性,作者在体外评估了 TSeL 生成和清除 ROS 的情况。TSeL 可以选择性地催化 H2O2 的还原,但对超氧阴离子和羟自由基几乎没有活性(图 1d、e)。同时,TSeL 表现出快速、持续的光诱导 ROS 生成能力,并在考虑封装效率和 ROS 生成速率的基础上确定了 TSeL 的计算公式(图 1f),用于后续的体内和体外研究。为了证实 TSeL 在 ROS 调节中具有相反的两面性,作者测定了 ROS 浓度的时间过程评估,并选择了将 TDTM 包封到以 DOPE 为主的脂质体中但不含 Se-DOPE 的 TL 脂质体作为阳性对照。光诱导的 ROS 在 TSeL 组和 TL 组中的产生率相当;然而,在谷胱甘肽(GSH)作为还原底物存在的情况下,TSeL 能够延缓并减缓 ROS 水平的急剧上升(图 1g),表明 Se-DOPE 的存在可以清除部分光诱导的 ROS。尽管如此,在光照下,TSeL + GSH 组的 ROS 生成速度仍明显快于清除速度,这有利于消灭细菌感染。此外,ROS 的产生和清除可以循环进行,经过几个循环后,TSeL 组的 ROS 水平几乎维持在初始光照射前的水平,而 TL 组的 ROS 水平则急剧升高(图 1h)。所有这些结果都表明,光诱导的 ROS 生成是一个超快的过程,有利于抗菌治疗;ROS 的催化降解是一个缓慢的过程,有利于伤口愈合。
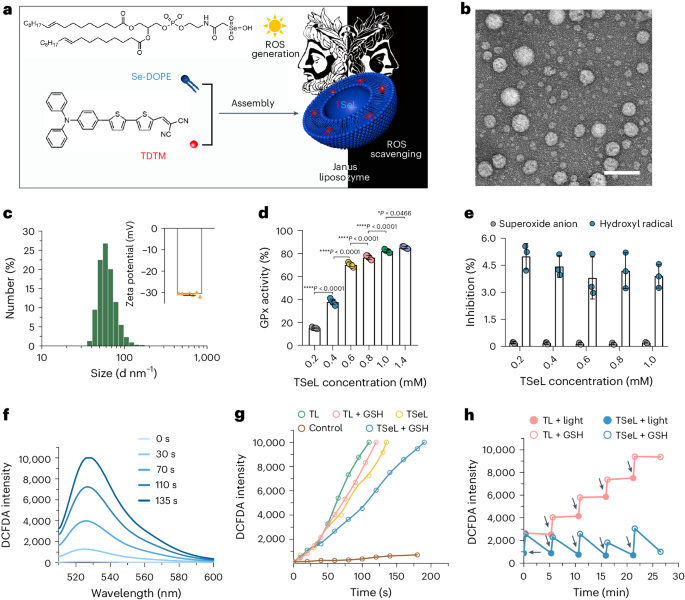
图 1:TSeL 的制备和表征
TSeL 促进了细菌的大量死亡
基于产生 ROS 的能力,作者进一步研究了 TSeL 的抗菌效果。作者假设,由于静电排斥,细菌对 TSeL 的吸收在能量上是不利的,这对于 TSeL 通过光动力疗法促进细菌死亡而不是将细菌从致命的氧化应激中解救出来至关重要(图 2a)。为了验证假设,用 DMAO 分别标记金黄色葡萄球菌、铜绿假单胞菌和耐甲氧西林金黄色葡萄球菌(MRSA),并用结构照明荧光显微镜(SIM)观察细菌(绿色)和 TSeL(红色)的共定位。与作者的假设一致,绿色和红色没有合并,这意味着 TSeL 和细菌之间没有直接的相互作用(图 2b)。
随后,在体外全面评估了白光照射 TSeL(TSeL + L)的抗菌性能。不出所料,TSeL + L 对金黄色葡萄球菌、铜绿假单胞菌和 MRSA 的抑制率接近 100%(图 2c),表明其具有广泛而高效的抗菌特性。为了进一步探究 TSeL + L 的抗菌机制,对其进行了扫描电子显微镜(SEM)观察,结果发现由于光诱导产生的 ROS 导致膜裂解,微生物明显破裂(图 2d)。
TSeL 保护成纤维细胞免受氧化损伤
根据研究设计,TSeL能有效清除光动力疗法和失衡氧化还原微环境产生的过量活性氧(ROS),从而减少对真核生物和组织的氧化伤害(图 2e)。通过在体外使用小鼠成纤维细胞(L929)测试,研究人员发现TSeL可以迅速被细胞吸收,并从溶酶体中逃逸到细胞质中发挥抗氧化作用(图 2f,g)。此外,TSeL处理能显著降低细胞内ROS浓度,有效缓解氧化应激(图 2h)。尽管TSeL在光照下会产生ROS,但其光毒性较弱,与对照组相比,细胞死亡率显著降低。(图2i)进一步的实验显示,在TSeL的保护下,成纤维细胞中的氧化还原平衡得以恢复,特别是通过提高抗氧化基因(如Gpx1、Cat和Sod2)的表达(图 2j-l)。这表明TSeL不仅能减少ROS损伤,还能为细胞提供保护,防止由ROS引发的细胞凋亡。这些发现为TSeL在临床应用中提供了重要的基础,尤其是在需要管理氧化应激的治疗中。
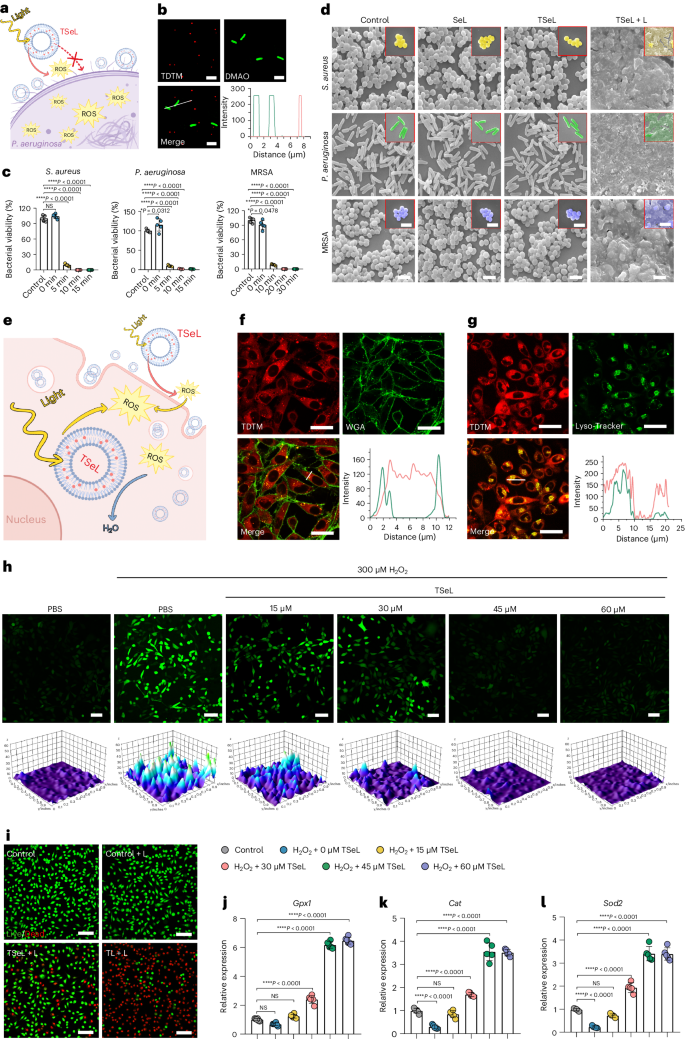
图2:TSeL体外抗菌活性和细胞保护作用评价
STZ诱导的糖尿病小鼠模型的治疗作用
为了评估TSeL在体内的Janus效应,作者使用了链脲佐菌素(STZ)诱导的糖尿病小鼠与MRSA感染的伤口模型(图3a)。在这一模型中,与正常小鼠相比,糖尿病小鼠的伤口愈合明显受损。在接受了TSeL和光照处理的组别中,15天后细菌几乎完全被清除,同时这些组别的活性氧(ROS)水平也因脂质酶的抗氧化作用而显著降低(图 3d,e)。特别地,TSeL + L处理的小鼠在手术后15天内伤口闭合速度快于其他组,且小鼠体重得以恢复。
此外,经TSeL + L处理的伤口在第15天展现出更厚的肉芽组织和更长的再生表皮(图 3b、c)。与其他组相比,这些伤口中的胶原纤维更丰富且结构更整齐(图 3h)。此外,TSeL + L处理的伤口还显示出更高的血管化程度,表现为α-平滑肌肌动蛋白(α-SMA)和CD31的密度增加(图 3i-l)。综上所述,TSeL + L处理不仅能有效消除MRSA感染,还能加速糖尿病伤口的闭合,促进再上皮化和血管生成,显示出在治疗严重糖尿病伤口中的潜在应用价值。
TSeL 和 SeL 调节糖尿病伤口的免疫稳态
使用第 15 天伤口组织的批量 RNA 测序(RNA-seq)进一步研究了 TSeL + L 处理所观察到的伤口加速愈合。该分析表明,促炎特征基因下调,而与伤口愈合、血管生成和抗氧化功能相关的基因上调(图 3m)。京都基因和基因组百科全书(KEGG)通路富集分析显示,免疫系统在很大程度上参与其中(图 3n),T 细胞受体(TCR)和白细胞介素(IL)-17 信号也在差异表达基因中被发现(图 3o)。值得注意的是,γδ T 细胞数量有所增加(图 3p)。Janus 处理主要诱导产生 IL-17 的 γδ T 细胞(图 3p),而不是产生干扰素(IFN)-γ 或 IL-4 的 γδ T 细胞。

图3:STZ诱导的MRSA感染糖尿病小鼠体内伤口愈合效果及伤口免疫稳态分析
SeL 直接诱导巨噬细胞 M1 至 M2 极化
为了深入探究SeL的作用,研究人员在巨噬细胞系(RAW264.7)中评估了其对巨噬细胞极化的影响。实验结果显示,SeL可以抑制由脂多糖(LPS)和IFNγ诱导的M1型巨噬细胞,同时促进M2型巨噬细胞的表达,从而推动巨噬细胞从M1向M2转变(图 4a)。特别地,含SeL的样本中CD206阳性细胞的比例更高,而诱导型一氧化氮合酶(iNOS)阳性细胞比例显著降低,这突显了SeL的抗炎作用。RT-qPCR分析进一步验证了这一结果,表明炎症因子被抑制而抗炎因子得到了提升(图 4b-g)。此外,研究也在骨髓衍生巨噬细胞(BMDMs)中进行,结果表明,随着SeL浓度的增加,在非极化条件下M1巨噬细胞显著减少,M2巨噬细胞逐渐增加(图 4h,i)。在M1极化条件下,SeL还促进了M1向M2表型的转变,与前述结果一致(图 4j,k)。这些研究表明,SeL能有效促进巨噬细胞由M1向M2极化,显示出其潜在的抗炎和免疫调节作用。

图4:SeL可以直接或通过γδT介导的方式诱导抗炎巨噬细胞极化
SeL促进γδT细胞诱导M2巨噬细胞极化
为了探究T细胞在MRSA感染的糖尿病伤口愈合中的角色,研究人员使用了缺乏功能性T细胞的Rag1-/-小鼠模型。与正常的糖尿病小鼠相比,这些小鼠的伤口愈合明显延迟(图 4l)。研究假设SeL能够调节γδ T细胞,从而促进巨噬细胞从M1向M2的转变。为验证这一点,研究发现SeL能增加γδ T细胞产生IL-17A的频率,同时降低IFNγ的频率(图 4o、p)。进一步实验显示,SeL处理的γδ T细胞的培养液能显著降低M1巨噬细胞的数量和M1/M2极化比率(图 4q,r)。当使用SeL及其处理过的γδ T细胞培养液共同处理骨髓衍生巨噬细胞(BMDMs)时,这种效果更为显著。这表明SeL通过直接调节γδ T细胞的IL-17A和IFNγ的产生,进一步加强了巨噬细胞的M1到M2的转变,显示出其在免疫调节中的潜在作用。
db/db 小鼠的单细胞转录组景观
为了验证Janus脂联酶在2型糖尿病治疗中的效果,作者使用了成熟的db/db小鼠模型。与STZ诱导的小鼠模型相似,TSeL + L处理可降低氧化应激,并促进胶原沉积与血管形成,从而在第15天明显加速伤口愈合。
作者进一步通过收集db/db小鼠皮肤伤口的单细胞悬浮液,并分析了单细胞转录组(图 5a)来深入了解TSeL + L处理的分子机制(图 5b)。通过单细胞转录组分析,作者注释了11种主要细胞类型(图 5c),并利用假时态分析追踪了与巨噬细胞相关的细胞状态转变。(图 5d)分析显示在TSeL + L处理后,M1型巨噬细胞减少而M2型增加。此外,γδ T细胞在治疗后显著增加,并主要贡献于产生IL-17A的T细胞池(图 5e-g)。
流式细胞术和单细胞测序结果显示,治疗后M1型巨噬细胞减少,M2型和IL-17A+ γδ T细胞增加(图 5m)。分析还发现γδ T细胞与巨噬细胞之间以及成纤维细胞和内皮细胞之间存在重要的细胞间交流,这在伤口愈合过程中发挥关键作用。综合这些结果,TSeL + L处理通过调控免疫细胞和细胞因子产生,有效促进了糖尿病伤口的愈合。
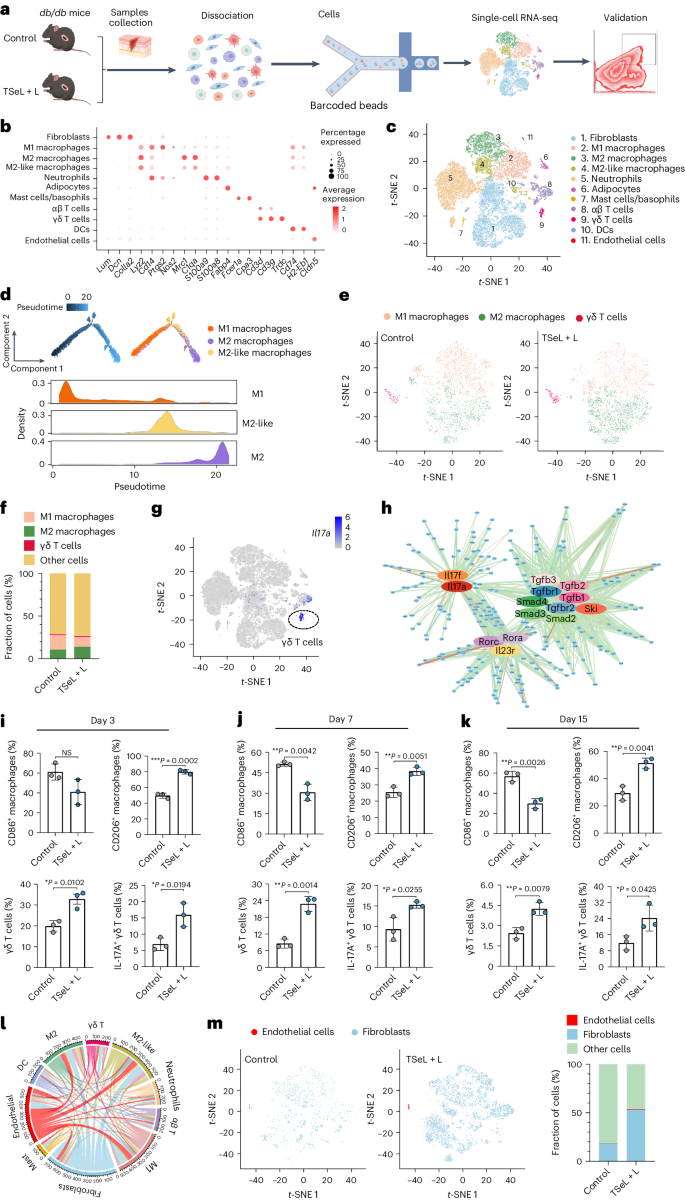
图 5:db/db 小鼠模型中的单细胞景观
感染糖尿病猪模型的治疗效果
为了进一步评估 TSeL 在体内的作用,作者建立了一个金黄色葡萄球菌感染的糖尿病猪模型(图 6a)。经 TSeL + L 和 SeL 处理的伤口显示伤口闭合速度加快(图 6b、c)。值得注意的是,TSeL + L 处理的伤口表皮最厚,分层完整,胶原纤维更丰富且组织良好,尤其是大量齿嵴结构的形成显著增加(图 6d-f)。同时,DHE 染色显示 TSeL + L- 和 SeL 处理组的 ROS 水平均显著降低(图 6g,j)。CD31 和 α-SMA 的免疫染色分析表明,TSeL + L 和 SeL 处理组的血管生成增加(图 6h,i,k,l)。总之,作者的结果表明 TSeL 足以促进糖尿病猪伤口的闭合。

图6:金黄色葡萄球菌感染糖尿病巴马小型猪体内伤口愈合效果
小结
总之,作者开发了一种促进糖尿病感染伤口程序化愈合的 Janus 脂质酶 TSeL。在治疗初期,白光照射激活了 TSeL 中的光敏剂 TDTM,迅速产生的 ROS 根除了糖尿病伤口中的细菌入侵。随后,TSeL 中的 GPx 类脂质酶 SeL 发挥抗氧化作用,清除 ROS,减轻氧化应激。同时,SeL通过直接相互作用和γδ T细胞依赖途径,诱导巨噬细胞从M1(促炎)表型极化到M2(抗炎)表型,从而调节免疫稳态。这一程序化过程促进了皮肤的再上皮化和无疤痕再生(图 6m)。总之,作者的工作为治疗 DFI 及其他急性或慢性伤口感染(如静脉溃疡、烧伤和植入物相关感染)提供了一条前景广阔的策略途径。



